電池といえば乾電池を思い浮かべる方が多いと思いますが、乾電池だけではなく太陽電池や燃料電池も「電池」と呼ばれています。電池の一覧表を説明し、特に一次電池と二次電池の種類と特徴を詳しく説明します。
電池とは?
電池とは、化学エネルギーや光エネルギーや熱エネルギーを電気に変換する装置です。
電池の種類
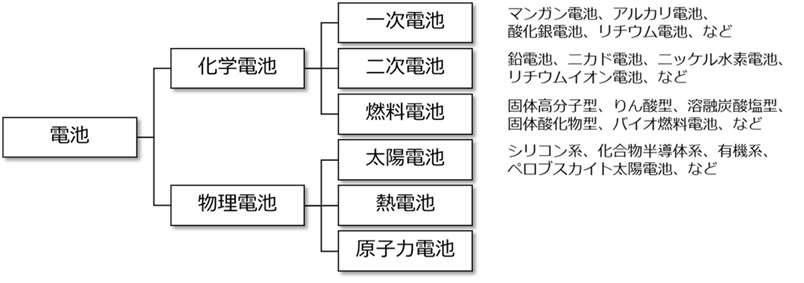
電池は、化学反応から電気をつくる「化学電池」と、熱や光といった物理エネルギーから電気をつくる「物理電池」の2種類に大別されます。
化学電池には、化学エネルギーを一度だけ電気エネルギーに変換できる「一次電池」と、放電過程で化学エネルギーを電気エネルギーに変換し、充電過程で電気エネルギーを化学エネルギーに変換して繰り返し充放電できる「二次電池」と、化学反応により発生した電気を継続的に取り出す「燃料電池」の3種類があります。
物理電池には、太陽の光エネルギーを電気エネルギーに変換する「太陽電池」と、熱エネルギーを電気エネルギーに変換する「熱電池」と、放射性元素が原子核崩壊を起こす際に発生する熱などを電気エネルギーに変換する「原子力電池」の3種類があります。
化学電池
化学電池の仕組み
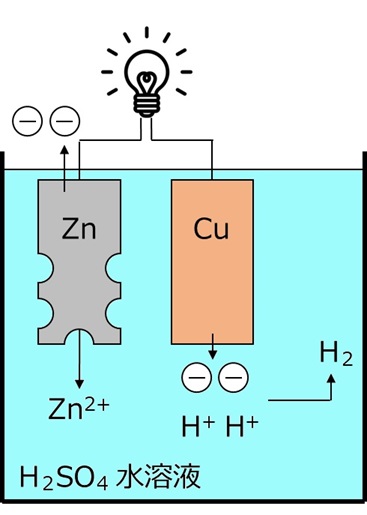
化学電池は、金属がイオンになる時に電子を放出する現象を利用します。例えば下のボルタ電池では、亜鉛が硫酸中でイオンになるとともに電子を放出し、放出された電子が導線を通って銅電極に移動し、水素イオンが電子を受け取って水素分子が発生します。電子が放出される亜鉛電極が負極、電子を受け取る銅電極が正極になります。
イオン化傾向と起電力
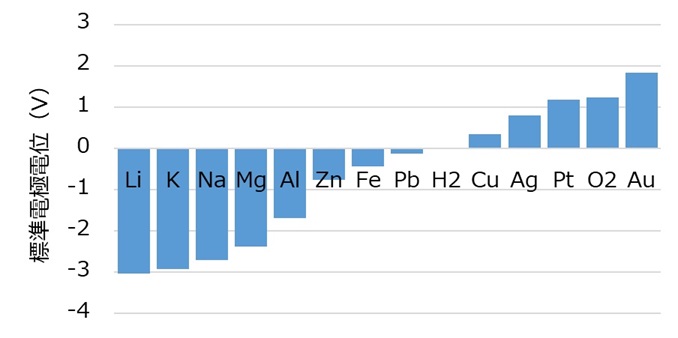
金属のイオンになりやすさはイオン化傾向で表され、イオン化傾向が大きい金属ほどイオンになりやすいです。
Li>K>Ca>Na>Mg>Al>Zn>Fe>Ni>Sn>Pb>(H2)>Cu>Hg>Ag>Pt>Au
金属のイオン化傾向は、水素H2が水素イオンH+ になる性質の強さと比較して数値で表すことができます。これを標準電極電位といいます。化学電池の正極と負極の標準電極電位の差を起電力と呼び、起電力が大きい組み合わせの電池の電圧は高くなります。
一次電池
一次電池にはたくさん種類があります。実用化されている代表的な一次電池を紹介します。
| 電池の種類 | 正極 | 負極 | 電解質 | 電圧(V) |
|---|---|---|---|---|
| マンガン電池 | 二酸化マンガン | 亜鉛 | 塩化亜鉛水溶液 | 1.5 |
| アルカリ電池 | 二酸化マンガン | 亜鉛 | 水酸化カリウム水溶液 | 1.5 |
| 酸化銀電池 | 酸化銀 | 亜鉛 | 水酸化カリウム水溶液 | 1.55 |
| リチウム電池 | 二酸化マンガン | リチウム | 有機溶媒 | 3 |
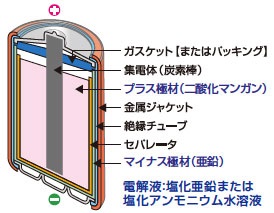
マンガン電池
マンガン乾電池は小さな電流を少しずつ使う用途に適しています。電解質は塩化亜鉛水溶液で弱酸性です。電解質には少量の塩化アンモニウムが加えられて、亜鉛の溶出を防いでいます。
代表的な用途:リモコン、キッチンタイマー、置き時計
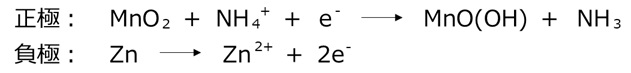
アルカリ電池
アルカリ電池の正極と負極はマンガン電池と同じですが、電解液にアルカリ性のKOH水溶液を使用しています。アルカリ性の電解液のため、電池反応が進みやすくなっています。アルカリ電池は大きなパワーを連続して使う用途に適しています。
代表的な用途:ラジコン、CDプレイヤー
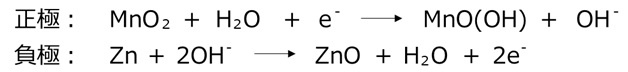
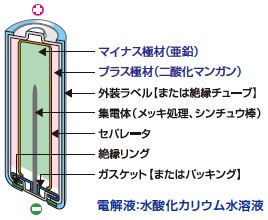
酸化銀電池
一般的な電池は使用すると電圧が低くなりますが、酸化銀電池は電気がなくなる直前まで電圧が下がりません。酸化銀電池は銀を使用しているためコストが高いですが、精密さが要求される用途で使用されます。
代表的な用途:医療機器、高級時計
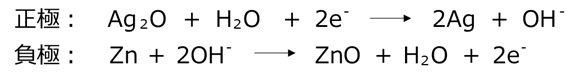
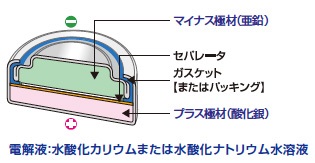
リチウム電池
リチウム電池は電圧が高く、電池容量が大きく、自己放電が少なく、低温でも使用可能といった特徴があります。イオン化傾向が大きいリチウムを使うため電圧が高くなり、電解液として有機溶媒を使うため凍結しにくくなっています。有機溶媒にはカーボネート系化合物が使用されます。一次電池のリチウム電池は、あとで紹介する二次電池のリチウムイオン電池とは別物です。
代表的な用途:寒冷地の屋外で使う機器、電池交換頻度を下げたい機器
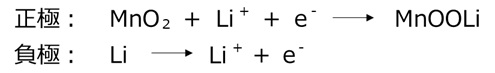
二次電池
二次電池の特徴は何といっても充電して再利用できることです。実用化されている代表的な二次電池を紹介します。
| 電池の種類 | 正極 | 負極 | 電解質 |
|---|---|---|---|
| 鉛電池 | 酸化鉛 | 鉛 | 希硫酸 |
| ニカド電池 | 水酸化ニッケル | カドミウム | 水酸化カリウム水溶液 |
| ニッケル水素電池 | 水酸化ニッケル | 水素吸蔵合金 | 水酸化カリウム水溶液 |
| リチウムイオン電池 | 炭素材料 | リチウム合金 | 有機溶媒+リチウム塩 |
| 電池の種類 | 電圧(V) | エネルギー密度 | 毒性 | コスト |
|---|---|---|---|---|
| 鉛電池 | 2 | 低 | 高 | 低 |
| ニカド電池 | 1.2 | 中 | 高 | 中 |
| ニッケル水素電池 | 1.2 | 中 | 低 | 高 |
| リチウムイオン電池 | 3.7 | 高 | 低 | 高 |
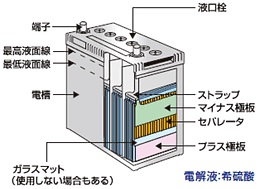
鉛電池
充電時はPb0やPb4+といった化学的に不安定な価数にしておき、安定なPb2+に変化するエネルギーを電気として取り出します。鉛蓄電池は安価な鉛を使用していて比較的大きな電圧を取り出せるのがメリットで、重いことがデメリットです。
代表的な用途:自動車用のバッテリー
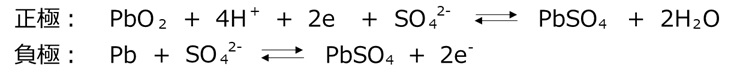
ニカド電池
ニカド電池(ニッケル・カドミウム電池)は内部抵抗が比較的低いため、大電流出力が可能です。 具体的には連続動作時に3C、瞬時動作時に10Cの放電が可能です。一方で毒性の高いカドミウムを使用すること、メモリー効果があることなどのデメリットため、他の電池に置き換えが進みました。
代表的な用途:ラジコンや電動工具といった大きな電力が必要な機器
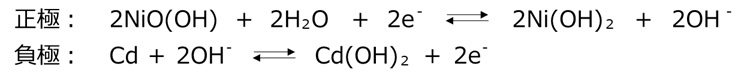
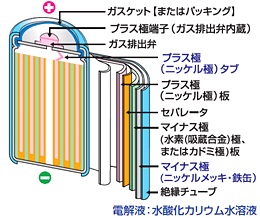
ニッケル水素電池
ニッケル水素電池は負極に水素吸蔵合金が使用されています。水素イオンは水素吸蔵合金の隙間に出入りすることができます。ニッケル水素電池は充放電の際に水素イオンが正極と負極の間を移動します。電極が溶解したり析出したりしないため、ニッケル水素電池は長寿命です。
ニッケル水素電池はニカド電池と比較して2倍以上のエネルギー密度があり、ニカド電池と同様にメモリー効果を起こします。
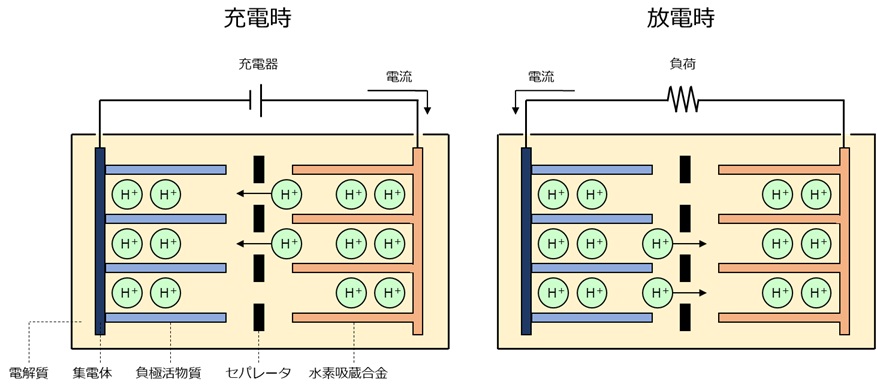
代表的な用途:幅広い用途に使用されていましたが、リチウムイオン電池に置き換えられつつあります。
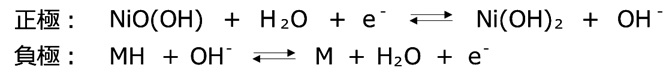
※Mは水素吸蔵合金を表します。
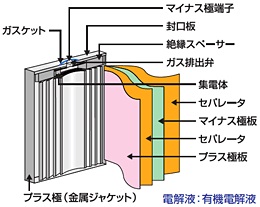
リチウムイオン電池
リチウムイオン電池に使用される正極のリチウム合金と負極の炭素材は、どちらもリチウムイオンを挿入する隙間のある材料です。リチウムイオン電池では、充放電の際にリチウムイオンが正極と負極の間を移動します。
リチウムイオン電池は、エネルギー密度が高い、高電圧、事故放電が少ない、長寿命、低温動作が可能、メモリー効果がない、といった優れた特徴があります。
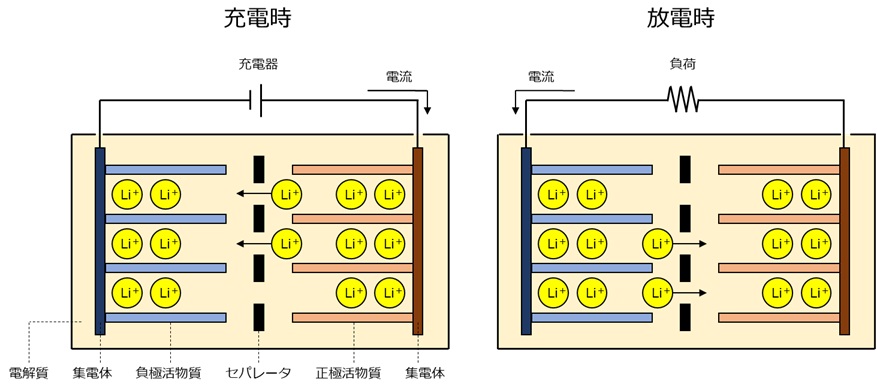
正極:CoO2 + Li+ + e– ←→ LiCoO2
負極:LiC6 ←→ C6 + Li+ + e–
※右矢印が放電、左矢印が充電です。正極にコバルト酸リチウムLiCoO2、負極にグラファイトを使用した場合の式です。負極のグラファイトはC6で表現しています。
燃料電池
燃料電池は水の電気分解の逆反応で電気をつくる発電装置です。燃料電池は電池と呼びますが、外部から水素などの物質を供給し続けないと電気を取り出せないため、ほかの化学電池とは異なり発電装置と考えることができます。
水素 + 酸素 → 水 + 電気エネルギー
燃料電池は発電方法によって以下の7種類に分類されます。
- 固体高分子型燃料電池 (PEFC)
- りん酸型燃料電池 (PAFC)
- 溶融炭酸塩型燃料電池 (MCFC)
- 固体酸化物型燃料電池 (SOFC)
- アルカリ電解質型燃料電池 (AFC)
- 直接型燃料電池 (DFC)
- バイオ燃料電池 (BFC)
物理電池
太陽電池
太陽電池とは光起電力効果を利用して、太陽の光エネルギーを電気エネルギーに変換する発電装置です。太陽電池は使用される材料によって以下の4種類に分類されます。
- シリコン系太陽電池(単結晶、多結晶、アモルファス)
- 化合物半導体系太陽電池
- 有機系太陽電池(色素増感太陽電池、有機薄膜太陽電池)
- ペロブスカイト太陽電池
熱電池
熱をかけると電気を発生させる熱電変換素子を利用する発電装置です。実際に用いられている熱電変換素子は、p型半導体とn型半導体が使われます。
原子力電池
放射性物質が崩壊するときに発生する熱を利用して、熱電変換素子から電気を取り出す装置です。日常的に使用されることはありませんが、太陽の光が届かない場所に飛ばす宇宙船など特殊な用途に使用されます。
まとめ
電池全体を紹介しました。一次電池としては、マンガン電池、アルカリ電池、酸化銀電池、リチウム電池を説明しした。二次電池としては、鉛電池、ニカド電池、ニッケル水素電池、リチウムイオン電池を説明しした。
関連書籍
電池全体についてわかりやすく説明されている本です。特にリチウムイオン電池について詳しく書かれています。入門書としておすすめです。
3.jpg)

-160x90.jpg)