こんにちは!けむさんです。
モル濃度(mol/L)と質量パーセント濃度(w/w%)は、化学実験や計算でよく使う基本中の基本。
でも、両者の定義の違いや変換の方法がごちゃごちゃになってしまう・・・という人も多いのでは?
そこでこの記事では、誰でもすぐに変換できるよう、わかりやすい解説と便利な計算ツールを用意しました!
目次
mol/L ⇄ w/w%の相互変換ツール
モル濃度(mol/L)と質量パーセント濃度(w/w%)の相互変換ツールです。計算してみよう!
リンク
モル濃度と質量パーセント濃度の違い
| 種類 | 定義 | 使われる場面 |
| モル濃度(mol/L) | 溶液1 L中に含まれる溶質のモル数 | 中和・滴定・反応式の計算など |
| 質量パーセント濃度(w/w%) | 溶液の全質量に対する溶質の質量の割合 | 実験操作・製品表示・日常用途など |
モル濃度(mol/L)とは?
モル濃度は、1リットルの溶液に何molの溶質が溶けているかを示す単位です。中和滴定や反応式の計算では、mol単位が基本になるので、mol/Lは化学反応や中和、滴定で重要な情報です。
例:1 mol/L のNaCl水溶液 → 1 L に 58.5 g(1 mol)のNaClが溶けている状態
質量パーセント濃度(w/w%)とは?
質量パーセント濃度は、溶液全体の質量に対して、溶質の質量が何%かを示すものです。実験室だけでなく、消毒用アルコールや医薬品など、製品ラベルでも広く使われる単位です。
例:5% w/w の食塩水 → 100 g 中に 5 g の食塩が入っている
モル濃度と質量パーセント濃度の相互変換の計算方法
モル濃度と質量パーセント濃度は単位が違うので、変換には以下の情報が必要です。
- 溶質のモル質量(g/mol)
- 溶液の密度(g/mL)
mol/L → w/w% に変換する式
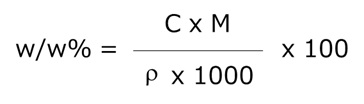
- w/w%:重量パーセント濃度(w/w%)
- C:モル濃度(mol/L)
- M:モル質量(g/mol)
- ρ:溶液の密度(g/mL)
例題:1 mol/L のNaCl水溶液(M=58.44、ρ=1.05 g/mL)の w/w% は?
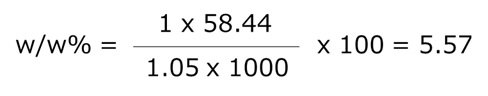
→5.57 w/w%
w/w% → mol/L に変換する式
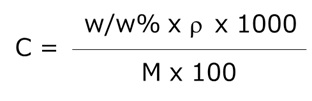
- w/w%:重量パーセント濃度(w/w%)
- C:モル濃度(mol/L)
- M:モル質量(g/mol)
- ρ:溶液の密度(g/mL)
例題:5% w/w のNaCl溶液(M=58.44、ρ=1.05 g/mL)の mol/L は?
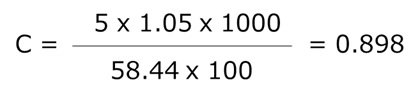
→0.898 mol/L
まとめ
- モル濃度(mol/L)と質量パーセント濃度(w/w%)は用途も単位も違う。
- 変換にはモル質量と密度が必須。
- 計算式は単純だけど、正確に変換するには注意が必要。
- この記事の濃度変換ツールを実験や勉強に活用しよう。
塾に通わなくても、全国レベルの難関大講師の授業が自宅で受けられる時代。それが、オンライン家庭教師「まなび場」です。
- 先生は、京大など難関大の現役生やプロ講師
- 自分で“逆指名”できるので、ミスマッチの心配なし
- 入会金・教材費・管理費、ぜんぶ無料!
- 授業はワンクリック、報告書つきで親も安心
「質」と「自由」を両立できる、次世代型の個別指導がここにあります。
まずは無料体験してみる!